lab life made easy
Labbox Italia - NOTIZIE - LABORATORIO E SCIENZA - SOLVENTI: TIPI, USI E IMPORTANZA NELLE SCIENZE
I solventi sono sostanze chimiche largamente utilizzate e fondamentali in numerosi ambiti scientifici, tra cui chimica, biologia e farmacia. Come suggerisce il nome, questi composti hanno la capacità di sciogliere altre sostanze, ma anche di trasportare molecole in soluzione (i cosiddetti “soluti”).
Nelle reazioni chimiche, i solventi spesso fungono da mezzo di reazione, ma possono anche influenzare direttamente la reattività e le proprietà fisiche e chimiche delle soluzioni. Per questo motivo sono strumenti essenziali nella ricerca, nell’analisi e nello sviluppo di nuovi prodotti chimici e materiali.
In questo articolo esploreremo cosa sono i solventi, i loro principali tipi e alcuni dei loro usi più comuni in chimica e biologia, evidenziando la loro importanza nella pratica scientifica.

Cosa sono i solventi e quali tipi esistono
I solventi si definiscono come sostanze capaci di sciogliere un soluto, formando una soluzione in cui il solvente rappresenta solitamente la parte predominante della miscela.
Sebbene esistano solventi gassosi, solidi o in stato supercritico, in laboratorio i più comuni sono quelli liquidi.
Una delle classificazioni più diffuse si basa sulla polarità, cioè sulla distribuzione delle cariche nelle loro molecole.
Solventi polari: il caso dell’acqua e altri esempi chiave
I solventi polari sono composti le cui molecole presentano una distribuzione asimmetrica delle cariche, con una zona parzialmente positiva e una negativa. Questa polarizzazione consente loro di interagire efficacemente con soluti polari o ionici, secondo la regola generale “il simile scioglie il simile”.
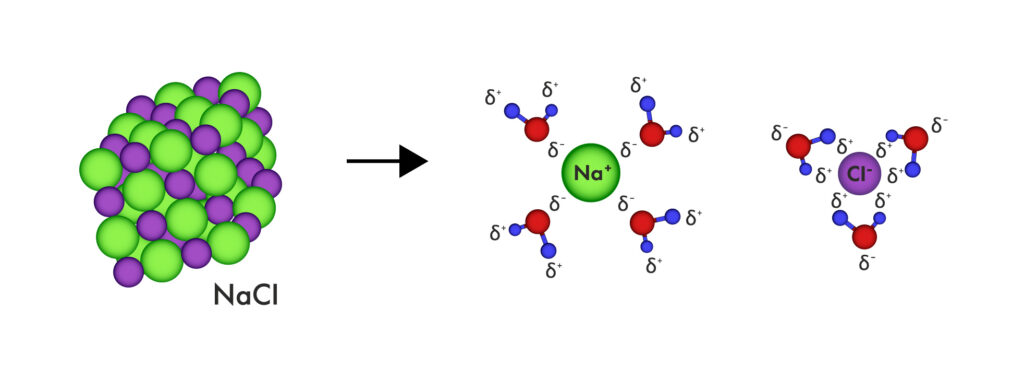
Schema della dissoluzione in acqua e dell’idratazione di un cristallo di cloruro di sodio (NaCl), il sale comune.
Esempio: l’acqua
L’acqua è il solvente polare più comune e biologicamente rilevante. Il citoplasma delle cellule, ad esempio, è costituito in gran parte da acqua, nella quale si sciolgono (e si disperdono) molte molecole come zuccheri, ioni e proteine.
Anche nella vita quotidiana osserviamo questo fenomeno: il sale da cucina (NaCl) si scioglie facilmente in acqua calda grazie alla sua polarità.
Altri esempi di solventi polari
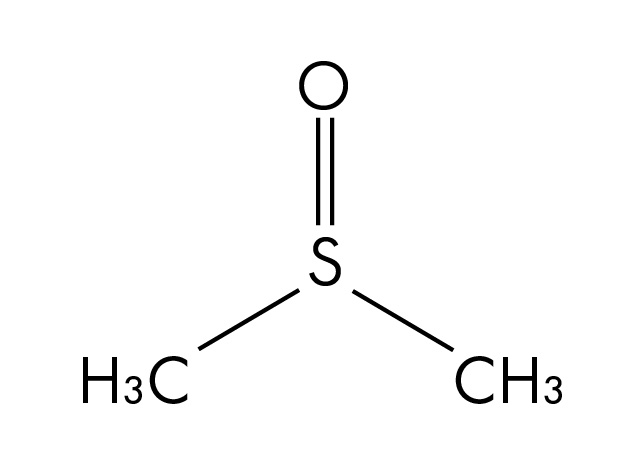
Struttura molecolare del dimetilsolfossido (DMSO), un solvente polare aprotico.
Solventi apolari: un mezzo inerte per reazioni specifiche
I solventi apolari presentano una distribuzione uniforme della carica elettrica e sciolgono composti apolari come grassi, cere e idrocarburi.
Nelle reazioni organiche che coinvolgono specie altamente reattive (come nucleofili o elettrofili), si preferiscono solventi chimicamente inerti. L’acqua, ad esempio, può risultare troppo reattiva e dare luogo a reazioni indesiderate. I solventi apolari o polari aprotici, invece, offrono condizioni di reazione più pulite e controllate.
Esempi di solventi apolari
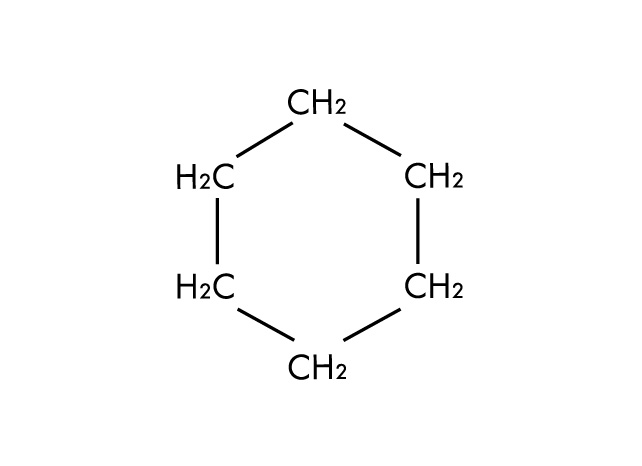
Struttura molecolare del cicloesano, un solvente apolare aprotico.
Applicazioni comuni in chimica e biologia
I solventi svolgono numerose funzioni chiave in laboratorio. Tra le più importanti:
1.Mezzo di reazione
I solventi fungono da ambiente in cui avvengono molte reazioni chimiche. La loro scelta influisce sulla solubilità dei reagenti, sulla velocità di reazione e sul meccanismo (SN1, SN2, ecc.).
2.Pulizia del materiale
Solventi come acetone o etanolo vengono utilizzati per pulire vetri e superfici grazie alla loro capacità di sciogliere grassi e contaminanti.
3.Estrazione di composti
In biologia i solventi si impiegano per estrarre metaboliti da tessuti.
– Etanolo o etanolo/acqua per fenoli e flavonoidi da piante
– Cloroformio per lipidi da tessuti animali
– Acetonitrile o metanolo (con acqua) per proteine e metaboliti polari
4.Tecniche analitiche
Nella cromatografia liquida ad alta prestazione (HPLC) o nella cromatografia su strato sottile (TLC), i solventi agiscono come fasi mobili (eluente).

Conclusioni
I solventi sono strumenti indispensabili in ogni laboratorio. Dalla dissoluzione di sali in acqua all’estrazione di lipidi o alcaloidi, le loro applicazioni sono numerosissime. La scelta del solvente giusto può determinare la riuscita di un esperimento o di un processo produttivo, rendendoli fondamentali in chimica, biologia e molte altre discipline scientifiche.
I solventi che offriamo in Labbox:
Attenzione
I prodotti chimici Labkem sono destinati esclusivamente all’uso in laboratorio e devono essere manipolati unicamente da professionisti del settore.
I prodotti chimici sono pericolosi; rispettare le istruzioni contenute nella scheda di sicurezza.
Le schede di sicurezza sono scaricabili gratuitamente sul nostro sito web: www.labbox.it
Per salvare il Suo carrello nella Sua area personale o richiedere un preventivo, effettui il login o si registri.
In questo modo, potrà accedere ai Suoi carrelli salvati ogni volta che ne avrà bisogno.
Tuttavia, se preferisce, può copiare o reinviare il link di questo carrello al Suo indirizzo e-mail per recuperarne il contenuto in seguito.
L'opzione per richiedere un preventivo è disponibile solo per gli utenti registrati.
La preghiamo di effettuare il login o creare un account per poter utilizzare questa funzionalità.
